技术领域
本发明属于神经生物学领域,具体涉及定向诱导hiPSC分化后的神经细胞体系、诱导方法及应用。
背景技术
人诱导多能干细胞(human induced pluripotent stem cells,hiPSC)来源的神经细胞对于细胞移植治疗缺血性脑卒中(以多种不同种系的神经细胞严重缺失为特点)具有显著效应。然而,现有的诱导hiPSC细胞分化为神经细胞的操作效率低,稳定性差。
干细胞生物学的最新研究进展为再生医学提供了依据,其中hiPSC细胞的定向分化可以为细胞移植治疗缺血性脑卒中(以各种神经元和神经胶质细胞的严重缺损为特性)患者提供了多种人类神经细胞。有效地诱导、纯化和植入人类神经细胞是建立以hiPSC细胞为基础的神经细胞疗法所必需的。许多有关高效分化神经细胞的方法草案已被提出。然而,这些方法不足以提供成熟的神经细胞谱系,致使幼稚细胞混杂于其中,导致脑内移植后畸胎瘤的形成。此外,某些方法只能分化产生一个窄谱的神经细胞系,不能满足治疗缺血性脑卒中所需的多种细胞类型。更重要的是,为将hiPSC细胞诱导的神经细胞应用于临床,诱导而来的神经系统细胞的分离纯化,以剔除非神经系统细胞及幼稚细胞是非常必要的。因此,建立基于hiPSC细胞的神经诱导和纯化系统已被人们期待已久(Rov,N.S.;Cleren,C.;Singh,S.K.;Yang,L.;Beal,M.F.;Goldman,S.A.Functional engraftment of human EScell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes.Nat.Med.12:1259–1268;2006;Yan,Y.P.;Yang,D.L.;Zarnowska,E.D.;Du,Z.W.;Werbel,B.;Valliere,C.;Pearce,R.A.;Thomson,J.A.;Zhang,S.C.Directed differentiation of dopaminergic neuronal subtypes fromhuman embryonic stem cells.Stem Cells 23:781–790;2005;Gerrard,L.;Rodgers,L.;Cui,W.Differentiation of human embryonic stem cells to neural lineages inadherent culture by blocking bone morphogenetic protein signaling.StemCells23:1234–1241;2005;Keirstead,H.S.;Nistor,G.;Bernal,G.;Totoiu,M.;Cloutier,F.;Sharp,K.;Steward,O.Human embryonic stem cell-derived oligodendrocyteprogenitor cell transplants remyelinate and restore locomotion after spinalcord injury.J.Neurosci.25:4694–4705;2005.)。
发明内容
本发明所要解决的技术问题是为了克服目前现有技术提供的神经细胞谱系不成熟,致使幼稚细胞混杂于其中导致脑内移植后畸胎瘤形成的不足,提供一种定向诱导hiPSC分化为神经细胞体系的方法、制得的神经细胞体系及其应用。本发明的方法诱导人类hiPSC细胞定向分化为神经系统细胞,同时抑制非神经系统细胞的生成,从而获得成熟、广谱的神经细胞群。该神经细胞群不仅经过体外验证为具有电冲动发放的成熟神经元,而且这类神经细胞群在小鼠体内实验中也被证实,具有有效的治疗神经系统疾病(如脑卒中、脑损伤)的作用。
本发明解决上述问题的技术方案之一是:一种定向诱导hiPSC分化为神经细胞体系的方法,其包括分阶段培养所述hiPSC诱导其神经分化,所述阶段包括:
阶段a.共培养所述hiPSC与骨髓基质细胞HS5于诱导培养基;
阶段b.用HS5条件培养基、即含有所述HS5的分泌液的诱导培养基连续培养所述hiPSC;
阶段c.用培养神经元细胞的基础培养基继续培养所述hiPSC。
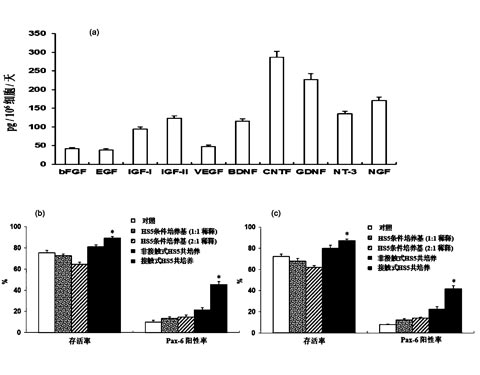
其中,阶段a中所述的所述诱导培养基为本领域常规的诱导培养基;较佳地,所述诱导培养基包括下述组分:20-25%血清替代品、0.5-1.5mM的谷氨酰胺、8-20ng/ml表皮生长因子、8-12ng/ml脑源性神经营养因子、8-15ng/ml神经营养因子-3、0.5-1.5ng/ml转化生长因子β3、400~700ng/ml头蛋白以及2-3%B27添加剂的DMEM/F12培养基,所述百分比为体积百分比。更佳地,为了在干细胞向神经细胞谱系分化的过程中有效地同步促进细胞分化产物的增殖活性,所述诱导培养基还包括1-1.5%非必需氨基酸、8-15ng/ml碱性成纤维细胞生长因子、0.08-0.15mMβ-巯基乙醇以及0.3-0.8mM双丁酰环磷酸腺苷。
进一步更佳地,所述培养基包括下述组分:20%血清替代品、1%非必需氨基酸、1mM的谷氨酰胺、0.1mMβ-巯基乙醇、10ng/ml碱性成纤维细胞生长因子、10ng/ml表皮生长因子、10ng/ml脑源性神经营养因子、10ng/ml神经营养因子-3、1ng/ml转化生长因子β3、0.5mM双丁酰环磷酸腺苷、500ng/ml头蛋白以及2%B27细胞培养添加剂DMEM/F12培养基。所述的血清替代品优选为KnockOut TM血清替代品。
阶段a中所述的共培养可以为直接接触共培养或者非直接接触共培养,较佳地为直接接触共培养。
阶段a中所述的骨髓基质细胞HS5为抑制分裂的HS5;较佳地,所述抑制分裂的方法为照射;更佳地,所述照射的条件为:γ射线辐照强度75-85Gy,照射时间为28-35分钟,所述的辐照强度优选为80Gy,所述的照射时间优选为30分钟。
阶段a中所述的共培养的时间为本领域常规,较佳地为10-18天,更佳地为2周。
阶段b中所述的连续培养的时间为本领域常规,较佳地为8-18天,更佳地为2周。
阶段c中所述的继续培养的时间为本领域常规,较佳地为10-18天,更佳地为2周。
阶段b中所述的HS5条件培养基的制备方法为1)将5×106~2×107个经照射后的HS5细胞接种到8-15ml所述诱导培养基中;2)连续1~8天收集培养细胞的上清;3)将上清与所述诱导培养基以1:1~8:1比例混合即得;更佳地,所述HS5条件培养基的制备方法为:1)将1×107个经照射后的HS5细胞接种到10ml所述诱导培养基中;2)连续4天收集培养细胞的上清;3)将上清与所述诱导培养基以1:1比例混合即得。
阶段c中所述的基础培养基为添加有:15-30ng/ml bFGF、15-30ng/ml EGF、1-3%B27添加剂、8-12μM佛司可林和0.1-0.3mM抗坏血酸的neurobasal培养基;较佳地,为了有效地维系处于分化终末阶段的成熟神经元的存活率,所述基础培养基还包括0.5-1.5%N2添加剂和0.5-1.5%胎牛血清;更佳地,阶段c所述的基础培养基为添加有:20ng/ml bFGF、20ng/ml EGF、2%B27添加剂、1%N2添加剂、1%胎牛血清、10μM佛司可林和0.2mM抗坏血酸的neurobasal培养基,所述百分比为体积百分比。
本发明解决上述问题的技术方案之二是:一种上述方法诱导得到的神经细胞体系。较佳地,所述神经细胞体系包括:神经干细胞59.3±1.9%、多种功能性神经元28.2±2.1%、星形胶质细胞9.1±0.8%以及少突胶质细胞4.8±0.6%,所述百分比为占整个神经细胞体系的个数百分比。其中,所述的多功能性神经元细胞包括:多巴胺能神经元5.4±0.4%、乙酰胆碱能神经元9.3±0.6%、γ-氨基丁酸能神经元3.9±0.3%、5-羟色胺能神经元6.5±0.5%以及幼稚神经元3.1±0.4%;所述百分比为占整个神经细胞体系的个数百分比。
本发明解决上述问题的技术方案之三是:一种上述的神经细胞体系在制备脑组织细胞修复制剂中的应用;较佳地,所述制剂为治疗缺血性脑卒中、脑出血或者外伤导致的脑损伤的制剂。
本发明解决上述问题的技术方案之四是:一种初步诱导hiPSC分化为神经细胞体系的诱导培养基,所述培养基为包括下述组分:20-25%血清替代品、0.5-1.5mM的谷氨酰胺、8-20ng/ml表皮生长因子、8-12ng/ml脑源性神经营养因子、8-15ng/ml神经营养因子-3、0.5-1.5ng/ml转化生长因子β3、400~700ng/ml头蛋白以及2-3%B27添加剂的DMEM/F12培养基,所述百分比为体积百分比;较佳地,所述培养基还包括1-1.5%非必需氨基酸、0.08-0.15mMβ-巯基乙醇、8-15ng/ml碱性成纤维细胞生长因子以及0.3-0.8mM双丁酰环磷酸腺苷。若上述培养基组分的含量低于上述数值范围的下限,则hiPSC在分化过程中的存活率很低(分化产物的总存活率低于40%);若高于上述数值范围的上限,则hiPSC的分化产物不但存活率低(低于45%),而且hiPSC向神经谱系细胞的分化效率亦显著降低(低于24%)。
在本发明一较佳实施例中,所述培养基为包括下述组分:20%血清替代品、1%非必需氨基酸、1mM的谷氨酰胺、0.1mMβ-巯基乙醇、10ng/ml碱性成纤维细胞生长因子、10ng/ml表皮生长因子、10ng/ml脑源性神经营养因子、10ng/ml神经营养因子-3、1ng/ml转化生长因子β3、0.5mM双丁酰环磷酸腺苷、500ng/ml头蛋白以及2%B27细胞培养添加剂的DMEM/F12培养基;更佳地,所述血清替代品为KnockOut TM血清替代品。
本发明解决上述问题的技术方案之五是:一种定向诱导hiPSC分化为神经细胞体系的HS5条件培养基,其为含有骨髓基质细胞HS5的分泌液的诱导培养基;所述HS5为经过照射的HS5;所述照射的条件为:γ射线辐照强度75-85Gy,照射时间为28-35分钟,所述辐照强度优选为80Gy,所述照射时间优选为30分钟;
较佳地,所述HS5条件培养基通过下述制备方法制得:1)将5×106~2×107个经照射后的HS5细胞接种到8-15ml所述诱导培养基中;2)连续1~8天收集培养细胞的上清;3)将所述上清与所述诱导培养基以1:1~8:1比例混合即得。其中,步骤1)中,若细胞数低于5×106个,则细胞接种后、照射前的存活率较低(一般会低于80%),而且产生细胞分泌物的浓度较低;若细胞数高于2×107个,则细胞接种过于拥挤,接受照射后的死亡率较高(可高于50%)。步骤2)中,若收集细胞培养基上清的天数少于1天,则是一种对细胞资源的浪费;若天数高于8天,则因为HS5细胞因照射后逐步死亡而产生较多的炎性因子、凋亡因子,不利于对hiPSC的诱导培养。步骤3)中,收集的培养基上清与新鲜配制的诱导培养基的混合比例低于1:1,则混合后含有的HS5细胞分泌物浓度过低,不足以诱导hiPSC的神经分化;若混合比例高于8:1,则培养基上清所占比例过高,其内不只是含有有效的诱导成分,亦含有较高浓度的HS5的代谢废物和促凋亡因子,对于hiPSC的诱导是弊大于利的。
更佳地,所述HS5条件培养基通过下述制备方法制得:1)将1×107个经照射后的HS5细胞接种到10ml所述的诱导培养基中;2)连续4天收集培养细胞的上清;3)将所述上清与所述诱导培养基以1:1比例混合即得。
本发明解决上述问题的技术方案之六是:一种定向诱导hiPSC分化为神经细胞体系中培养神经元细胞的基础培养基,所述的基础培养基为包括:15-30ng/ml bFGF、15-30ng/ml EGF、1-3%B27添加剂、8-12μM佛司可林和0.1-0.3mM抗坏血酸的neurobasal培养基。若上述培养基组分的含量低于上述数值范围的下限,则可致hiPSC分化而来的成熟神经元的存活率较低(会低于60%);若高于上述数值范围的上限,则可引发成熟神经元发生凋亡而致使其存活率低(可低于50%)。
较佳地,所述基础培养基还包括0.5-1.5%N2添加剂和0.5-1.5%胎牛血清。更佳地,所述的基础培养基为包括20ng/ml bFGF、20ng/ml EGF、2%B27添加剂、1%N2添加剂、1%胎牛血清、10μM佛司可林和0.2mM抗坏血酸的neurobasal培养基,所述百分比为体积百分比。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
本发明将骨髓基质细胞(human bone marrow stromal cells,BMSC)HS5以及hiPSC共培养,可以诱导人类hiPSC细胞定向分化为神经系统细胞,同时抑制非神经系统细胞的生成,从而获得成熟、广谱的神经细胞群。该神经细胞群不仅经过体外验证为具有电冲动发放的成熟神经元,而且这类神经细胞群在小鼠体内实验中也被证实,具有有效的治疗神经系统疾病(如脑卒中、脑损伤)的作用。利用该发明中所使用的阶梯式培养方法以及一系列添加物,可以形成规范化、商业化的体外培养流程,从而迎合国内和国际上对于“iPS诱导与移植疗法”的临床与科研需求。
附图说明null实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
字母缩写:
hiPSC:Human Induced Pluripotent Stem Cell人类诱导多潜能干细胞
MEF:mouse embryonic fibroblasts小鼠胚胎成纤维细胞
KSR:knockout serum replacement血清替代物
bFGF:basic fibroblast growth factor碱性成纤维细胞生长因子
EGF:epidermal growth factor表皮生长因子
NEAA:non-essential amino acids非必需氨基酸
BDNF:brain-derived neurotrophic factor脑源性神经营养因子
NT-3:neurotrophin-3神经营养因子-3
GFAP:glial fibrillary acidic protein胶质原纤维酸性蛋白
MAP-2:microtubule-associated protein 2微管相关蛋白2
Nurr-1:nuclear receptor related protein-1核受体相关蛋白1
Oct-4:octamer binding transcription factor 4八聚体结合转录因子4
ALP:alkaline phosphatase碱性磷酸酶
另,本发明中未特别说明的百分比(%)一般为体积百分比。